Cautarea si clasificarea diferitelor modele in ceea ce priveste materia a inceput inca din cele mai vechi timpuri. In timpul lui Aristotel (circa 330 i.Hr.) apa, focul, pamantul si aerul au fost considerate elementele de baza pentru tot ceea ce ne inconjoara. De-a lungul timpului, numeroase observatii si experimente au dus la descoperirea de noi elemente si implicit a tabelul periodic (tabelul lui Mendeleev). Tabelul lui Mendeleev este sistemul de clasificare stiintific pentru elementele chimice.
CUPRINSUL ARTICOLULUI
Definirea Elementelor inainte de Tabelul Lui Mendeleev
Antoine Laurent Lavoisier a fost primul care a definit ceea ce este un element. El l-a descris ca materia de baza, care nu mai poate fi defalcata prin mijloace chimice. Aceasta a fost descrisa in lucrarea sa din anul 1789 „Tratatul asupra elementelor chimice”. Opera sa a inclus o modalitate de a numi noi elemente, impreuna cu 33 de elemente (unele s-au dovedit a fi amestecuri si compusi). Munca sa a fost bazata pe activitatea desfasurata anterior de alti specialisti in domeniu precum si de colegii sai.
Lucrul in curs de desfasurare
In 1828, Jons Jakob Berzeliou a stabilit un grafic de greutate atomica si caracterele utilizate pentru elementele chimice. Definirea grupurilor de triada a fost realizata de catre Johann Dobereiner in 1829. Aceasta a fost un model de „pre-tabelul lui Mendeleev”. In 1864, John Newlands a aranjat elementele chimice dupa greutatea atomica, fara spatiu pentru elementele care nu erau cunoscute. In 1869, Lothar Meyer a pus bazele unui tabel periodic, iar in acelasi timp, Dimitri Mendeleev a realizat propriul sau tabel periodic. Ambele modele erau bazate pe greutatea atomica, insa erau departe de ceea ce este astazi „Tabelul lui Mendeleev”.
Tabelul lui Mendeleev – Sistemul periodic al elementelor chimice recunoscute international
Modele diferite de elemente au fost vazute de un numar considerabil de oameni. Cu toate acestea, exista doar o persoana care iesea in evidenta ca fiind parintele fondator al tabelului periodic. Dimitri Mendeleev, un om de stiinta rus in chimie, este cunoscut ca tatal tabelului periodic sau a „Tabelului lui Mendeleev” din zilele noastre ce ii poarta numele. La momentul cand el lucra la aranjarea elementeleor pentru tabelul periodic, existau 63 elemente cunoscute. El a creat modelul folosind masa atomica si a prezis ca mai urmeaza sa se descopere si alte elemente.
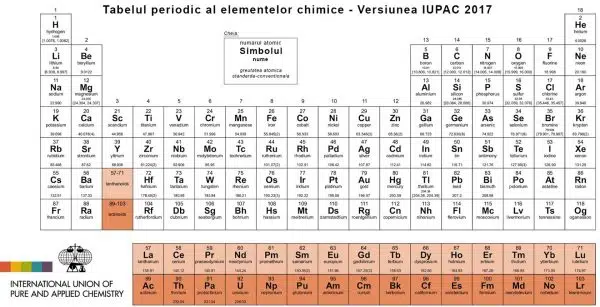
Tabelul lui Mendeleev actualizat – 1 decembrie 2018
Pe unul dintre blog-urile dedicate stiintei, pe care am inceput sa-l citesc de curand, am intalnit o stire cum ca IUPAC a modificat sistemul periodic al elementelor chimice, si chiar de mai multe ori.
IUPAC – International Union of Pure and Applied Chemistry – ne ofera ultima actualizare a Tabelului Periodic din data de 1 decembrie 2018. Aceasta include cele mai recente actualizari din iunie 2018, a Comisiei IUPAC pentru Acumulari Izotopice si Greutati Atomice (CIAAW). Este vorba despre specificatii speciale pentru argon si atribuirea unui interval pentru noul standard de greutate atomica ce reflecta aparitia variatiilor in greutatile atomice ale elementelor chimice din materialele terestre. Este un interval in paranteze patrate ce ofera limitele minime si maxime ale greutatilor atomice pentru elementele chimice. Pentru cei care au nevoie de greutati atomice pentru esantioane nespecifice, fara sa se tina cont de incertitudine, sunt disponibile valorile conventionale. Nu sunt specificate valori suplimentare pentru elementele care nu au izotopi cu o abundenta izotopica caracteristica in esantioanele terestre naturale.
IUPAC nu are nici o recomandare pentru o forma specifica a tabelului periodic, adica format din 18 coloane sau din 32, versiunea prezentata aici este in forma lunga conventionala si este recomandata pentru utilizare de catre toti.
Masa atomica revizuita pentru 14 elemente chimice din Tabelul lui Mendeleev
Masa atomica standard a argonului si a iridiului a fost modificata pe baza determinarilor si evaluarilor recente alte abundentelor izotopice terestre. Masa atomica a celorlalte 12 elemente chimice, toate avand doar un singur izotop stabil, a fost revicuita pe baza noii evaluari, astfel:
- aluminium (aluminiu): de la 26.981 5385(7) la 26.981 5384(3)
- argon: de la 39.948(1) la [39.792, 39.963]
- cobalt: de la 58.933 194(4) la 58.933 194(3)
- aur: de la 196.966 569(5) la 196.966 570(4)
- holmium: de la 164.930 33(2) la 164.930 328(7)
- iridiu: de la 192.217(3) la 192.217(2)
- mangan: de la 54.938 044(3) la 54.938 043(2)
- niobiu: de la 92.906 37(2) la 92.906 37(1)
- praseodim: de la 140.907 66(2) la 140.907 66(1)
- protactiniu: de la 231.035 88(2) la 231.035 88(1)
- rodiu: de la 102.905 50(2) la 102.905 49(2)
- terbiu: de la 158.925 35(2) la 158.925 354(8)
- tuliu: de la 168.934 22(2) la 168.934 218(6)
- ytriu: de la 88.905 84(2) la 88.905 84(1)
Sistemul periodic al elementelor chimice este schimbat de fiecare data cand cineva creeaza un element nou intr-un laborator. Aceasta schimbare este mai fundamentala decat documentarea unui element obscur, instabil, cu foarte putini oameni interesati de aceste lucruri. Greutate moleculara a zece elemente a fost schimbata de la un numar fix la un interval. De ce?
Pentru a intelege de ce sistemul periodic al elementelor a fost schimbat, avem nevoie sa ne intoarcem si sa revizuim un pic teoria atomica:
Protonii si numarul atomic definesc elementul
Fiecare atom are un anumit numar de ioni pozitivi, numiti protoni. Numarul de protoni intr-un atom determina caracteristicile acestui element, numele sau si locul in sistemul periodic al elementelor chimice (Tabelul Lui Mendeleev). Numarul de protoni dintr-un atom este numarul sau atomic. Diagrama este aranjata in ordine crescatoare a numerelor atomice, de la primul rand. Hidrogenul cu un singur proton, Heliu cu doi protoni, Litiu cu trei protoni, si asa mai departe.
Electronii sunt urmatoarele elemente subatomice importante
Electronii sunt ioni incarcati negativ si au greutatea foarte mica. Ponderea acestora in notatia stiintifica ajunge pana la zece la minus 19. Deci, pentru multe scopuri, cum ar fi calcularea greutatii unui element si pentru aceasta explicatie, puteti ignora greutatea electronilor. Un element neutru perceput are acelasi numar de electroni si protoni.
Ionii sunt particule incarcate
Daca un atom are un numar diferit de electroni decat de protoni, atunci acel atom este, de asemenea, un ion. Atomii cu electroni mai putini decat protoni, sunt incarcati pozitiv si se numesc cationi. Atomii cu electroni mai multi decat protoni sunt incarcati negativ si se numesc ioni.
In timp ce numarul de protoni intr-un atom identifica elementul, numarul de ioni din element dezvaluie cat de reactiv este elementul din Tabelul lui Mendeleev.
IUPAC – Uniunea internationala de chimie pura si aplicata – responsabila cu anuntarea oricarei aparitii in Tabelul lui Mendeleev sau in lumea chimiei, ne asteapta anul acesta la cel de-al 47-lea Congres International de Chimie in Paris (sursa oficiala: www.iupac2019.org).
Sub inaltul patronaj al presedintelui Republicii Fanceze Emmanuel Macron – IUPAC 2019 – Paris – 5-12 iulie
Tabelul lui Mendeleev este pentru toti!
Programele internationale de chimie, organizatiile si asociatiile din domeniu, ne ofera de cativa ani dreptul tuturor pasionatilor de chimie pura si aplicata, posibilitatea de a contribui la descoperirea de noi elemente chimice. Nu este simplu, nu este fara reglementari, fara standarde si fara obligatii, dar doresc sa va prezint pe scurt cum puteti face!
1. Criteriile pentru descoperirea unui element chimic nou
Evaluarea, daca un element chimic nou a fost „descoperit” nu este o sarcina usoara. La inceputul anilor ’90, IUPAC si IUPAP au fost infiintate pentru a stabili o serie de criterii ce trebuiesc indeplinite pentru ca noul element descoperit sa fie recunoscut. Detalii in: PAC 1991, Vol. 63, No. 6, pp. 879-886 si PAC 1993, Vol. 65, No. 8, pp. 1757-1814
2. Atribuirea numelui si a simbolului
Daca un element chimic a fost revendicat, inainte de validarea revendicarii si inainte ca elementul sa fie denumit in mod oficial, elementul chimic ce urmeaza sa fie introdus in Tabelul lui Mendeleev are un nume si simbol temporal. Recomandarile de stabilire a nomenclaturii sistematice a fost publicata in 1978 aici: PAC 1979, Vol. 51, No. 2, pp. 381-384
3. Validarea si atribuirea descoperirii unul element chimic nou
Revendicarile pentru descoperirea de elemente chimice noi apar din cand in cand in literatura stiintifica de specialitate. IUPAC alaturi de IUPAP, sunt implicate in evaluarea acestor afirmatii, in urma carora sunt publicate rapoartele tehnice IUPAC care revizuiesc fiecare referinta relevanta si recunosc laboratorul (laboratoarele) ale caror revendicari indeplinesc conditiile convenite la nivel international.
4. Denumirea unui element chimic nou
Cand descoperirea unui element chimic nou a fost validata si revendicarea descoperirii lui a fost atribuita, procesul de denumire poate incepe. Laboratorul caruia i sa atribuit descoperirea este invitat sa propuna un nume si un simbol. IUPAC va revizui propunerea si daca este de acord, dupa o revizuire publica suplimentara de 5 luni, va formaliza numele noului element chimic.
5. Cum sa denumiti un element chimic nou
In acest sens, IUPAC ofera un set de ghidaje care evidentiaza ce fel de nume poate avea un element chimic nou ce urmeaza a fi introdus in Tabelul lui Mendeleev. Atat radacina cat si terminatia trebuie sa fie in concordanta cu recomandarile convenite. Recomandarile detaliate au fost publicate in 2002 si o revizuire a fost publicata in 2016, pentru o mai buna concordanta cu elementele din grupele 17 si 18. Vezi PAC 2002, Vol. 74, No. 5, pp. 787-791 si PAC 2016, Vol. 88, No. 4, pp. 401–405
6. Grupele 1-18 si numele colective
Din 1988, IUPAC a recomandat ca grupurile (adica coloanele) sa fie pur si simplu numerotate de la 1 la 18. Vezi PAC 1988, Vol. 60, No. 3, pp 431-436
Lanthanoidele (de la La pana la Lu) si actinoizii (de la Ac pana la Lr) sunt denumiri colective recomandate de IUPAC.
7. Grupa 3
In prezent se pune intrebarea mai precis ce elemente chimice ar trebui plasate in grupa 3. Grupul 3 va consta in Sc, Y, Lu si Lr sau va fi compus din Sc, Y, La si Ac? Problema este dezbatuta din cand in cand si IUPAC a initiat un proiect pentru a rezolva aceasta problema.
8. Greutatile atomice standarde
Una din sarcinile Comisiei pentru Abundenta Izotopica si Greutatile Atomice este ca periodic sa revizuiasca determinarile greutatii atomice. Cel mai recent raport despre „Greutatile atomice a elementelor din 2013” a fost publicata in PAC in martie 2016 (PAC 2016, Vol. 88, No. 3, pp. 265–291). Si mai recent, pe 5 iunie 2018, Comisia a recomandat schimbari in greutatile atomice standarde a 14 elemente chimice.
Comisia a fost infiintata in 1899 si in prezent opereaza sub Divizia Chimie Anorganica de la IUPAC. Ea deasemenea revizuieste periodic compozitia izotopica a tuturor elementelor chimice (ultima publicata in martie 2016 – PAC 2016, Vol. 88, No. 3, pp. 293–306)









Lasă un răspuns